
Mg + H2SO4 đặc → MgSO4 + SO2 + H2O | Mg ra MgSO4
Phản ứng: Mg + H2SO4đặc → MgSO4 + SO2 + H2O

1. Phương trình phản ứng hóa học:
Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
2. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch không màu và khí không màu mùi hắc thoát ra.>
3. Điều kiện phản ứng
Dung dịch H2SO4 đặc.
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của Mg
Trong phản ứng hóa học này, Mg là chất khử và cho điện tử để các sản phẩm khác có thể được tạo ra.
4.2 Bản chất của H2SO4
- Trong phản ứng trên, H2SO4 là chất oxi hóa
5. Tính chất hóa học của Mg
- Magie là chất khử mạnh:
Mg → Mg2+ + 2e
5.1 Tác dụng với phi kim
Lưu ý:
- Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
5.2 Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
6. Tính chất hóa học của H2SO4
6.1 Axit sunfuric loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
6.2 Axit sunfuric đặc
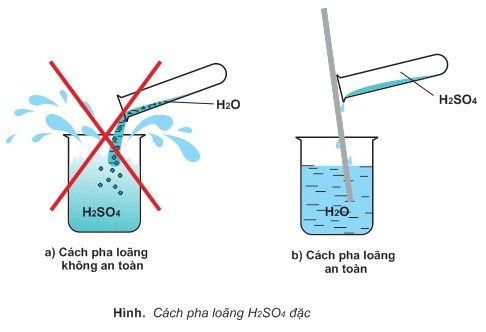
Cách pha loãng H2SO4
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Ứng dụng của H2SO4
H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng, kẽm,... và dùng để làm sạch bề mặt thép và dung dịch tẩy gỉ. Axit sunfuric còn được dùng để sản xuất nhôm sunfat (phèn làm giấy), các loại muối sunfat, chế tạo thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước mạ, sản xuất dược phẩm.
8. Cách thực hiện phản ứng
Cho kim loại sắt tác dụng với dung dịch axit sunfric đặc nóng
9. Bạn có biết
Mg phản ứng với H2SO4 đặc có thể sinh ra sản phẩm khử là SO2 ;H2S và S.
10. Bài tập liên quan
Ví dụ 1: Cho phương trình hóa học sau: Mg + H2SO4 → MgSO4 + SO2 + H2O
Tổng hệ số tối giản của phương trình trên:
A. 6
B.7
C. 8
D. 9
Hướng dẫn giải:
Đáp án B
Phương trình phản ứng: Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
Ví dụ 2: Cho các chất sau: Fe, Mg; FeSO4; Al; Ag; BaCl2 tác dụng với H3SO4 đặc nguội. Số phản ứng xảy ra là:
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải:
Đáp án D
Fe; Al thụ động trong H2SO4 đặc nguội.
Phương trình phản ứng: Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
2FeSO4 + 2H2SO4 → Fe2(SO4)3 + SO2 + 2H2O
BaCl2 + 2H2SO4 → BaSO4 + HCl
Ví dụ 3: Cho 4,8 g Mg tác dụng với dung dịch axit sunfuric đặc nóng thu được V lít khí SO2 điều kiện tiêu chuẩn. Giá trị của V là:
A. 2,24 lít
B. 4,48 lít
C. 1,12 lít
D. 5,6 lít
Hướng dẫn giải:
Đáp án B
nSO2 = nMg = 0,2 mol ⇒ V = 22,4 lít
Link nội dung: https://cmp.edu.vn/mgh2so4-dac-nong-a44719.html